Par :Collectif ReinfocovidL’ivermectine est utilisé comme médicament antiparasitaire depuis près de 40 ans chez l’homme et l’animal pour le traitement de nombreuses parasitoses. Elle possède également des propriétés antivirales sur lesquelles les scientifiques se sont logiquement penchés depuis le début de la crise. Ainsi, il existe aujourd’hui 68 études scientifiques dont 50 essais cliniques. L’analyse globale de l’ensemble des études existantes montre une amélioration de la survie et un rétablissement clinique plus rapide pour les patients traités par ivermectine
LE POINT DES DONNEES SCIENTIFIQUES EXISTANTES
QU’EST-CE QUE L’IVERMECTINE ?
L’ivermectine (IVM) est un médicament antiparasitaire à large spectre utilisé depuis plus de 30 ans pour le traitement et le contrôle des infections parasitaires. Chez l’homme, il permet notamment de traiter l’onchocercose (cécité des rivières), les filarioses lymphatiques et la gale (Õmura, 2008). Le contrôle de ces maladies par l’ivermectine lui a valu d’être inscrite sur la “Liste des médicaments essentiels” par L’Organisation Mondiale de la Santé (OMS). L’ivermectine est également utilisée en médecine vétérinaire pour le traitement des endo- et ecto-parasites des animaux d’élevage.
William C. Campbell et Satoshi Ōmura, qui ont découvert et développé l’ivermectine, ont reçu le prix Nobel de médecine en 2015 récompensant l’ensemble leurs travaux sur cette molécule (Crump and Omura, 2011).
L’ivermectine, avec plus de 3,7 milliards de doses distribuées dans le monde au cours des 40 dernières années, possède un excellent profil de sécurité. De nombreuses études font état de faibles taux d’événements indésirables, dont la majorité sont légers, transitoires et largement attribués à la réaction inflammatoire de l’organisme à la mort des parasites contre lesquels le traitement est dirigé (Kircik et al., 2016). Il est à noter que l’ivermectine cible les canaux chlorures glutamate-dépendant des invertébrés, absents chez les mammifères, assurant ainsi une très bonne innocuité du médicament.
L’ivermectine possède également des propriétés antivirales, antibactériennes, anticancéreuses et anti-inflammatoires. Concernant ses propriétés antivirales, l’ivermectine a montré ses puissants effets antiviraux in vitro contre plusieurs virus à ARN, tels que le virus Zika, le virus de la grippe A, le virus de la maladie de Newcastle, le virus Chikungunya, le virus de la fièvre jaune, le virus de la dengue, le virus de l’encéphalite japonaise mais également le VIH et les virus à ADN tels que le polyomavirus BK et l’herpèsvirus équin de type 1 (Heidary and Gharebaghi, 2020). Elle a donc rapidement été envisagée et évaluée comme un médicament possible du SARS-CoV-2 et fait l’objet de recherches approfondies dans le cadre d’essais cliniques (Gupta et al., 2020).
COMMENT AGIT L’IVERMECTINE SUR LE SARS-COV-2 ?
Depuis le début de la crise, plusieurs études ont dévoilé les mécanismes d’action possibles de l’ivermectine en traitement du SARS-CoV-2 :
- L’ivermectine réduit l’entrée du virus SARS-CoV-2 dans nos cellules et donc l’infectiosité du virus en se liant à la protéine Spike du Sars-Cov-2 et empêchant ainsi sa liaison avec le récepteur ACE-2 présent à la surface de nos cellules (Lehrer and Rheinstein, 2020).
- L’ivermectine réduit la réplication de l’ARN viral du SARS-CoV-2 (Caly et al., 2020) en interférant avec plusieurs protéines requises pour la réplication du virus (Lehrer and Rheinstein, 2020; Sen Gupta et al., 2020) ainsi que l’enzyme RdRp (SARS-CoV-2 RNA-dependent RNA polymerase) (Swargiary, 2020).
- L’ivermectine empêche le virus de « communiquer » avec le noyau de nos cellules : La protéine cargo du SARS-CoV-2 se lie à l’Importin (IMP) α/β1 de l’hôte afin de migrer dans le noyau et de réduire la réponse antivirale de la cellule hôte. L’IVM interagit directement avec l’IMPα et empêche son interaction avec IMPβ1, empêchant ainsi l’heterodimere Importin α/β1 de se lier à la protéine virale cargo du SARS-CoV-2 et donc son entrée dans le noyau (Caly et al., 2020; Yang et al., 2020). L’IVM bloque ainsi la reconnaissance du signal de localisation nucléaire (NLS) par le virus.
- L’ivermectine exerce également des effets anti-inflammatoires en bloquant la voie inflammatoire NF-kB (le plus puissant médiateur de l’inflammation) et la production de cytokines (Zhang et al., 2008, 2009; Ci et al., 2009) et peut donc réduire la tempête cytokinique associée à la phase tardive de Covid19.
Des études In vivo chez l’animal ont montré l’intérêt de l’ivermectine dans l’infection par le SARS-CoV-2 :
- L’ivermectine diminue de manière significative la charge virale et protège contre les lésions des organes dans de multiples modèles animaux lorsqu’ils sont infectés par le SARS-CoV-2 ou par des coronavirus similaires (Arévalo et al., 2020; De Melo, G.D. et al., 2020).
ACTION DE L’IVERMECTINE EN CLINIQUE DANS LA COVID19
- L’ivermectine prévient la transmission et le développement de la maladie Covid19 chez les personnes exposées à des patients infectés (Carvallo, Hirsch, Psaltis, et al., 2020; Elgazzar et al., 2020; Priyamadhaba Behera et al., 2021; Bernigaud et al., 2021; Hellwig and Maia, 2021; Shouman et al., 2021).
- L’ivermectine accélère la guérison et prévient la détérioration chez les patients présentant une maladie légère à modérée traitée tôt après les symptômes (Alam, Murshed, Bhiuyan, et al., 2020; Carvallo, Hirsch, and Farinella, 2020; Elgazzar et al., 2020; Gorial et al., 2020; Khan, M.S.I. et al., 2020; Morgenstern et al., 2020).
- L’ivermectine accélère le rétablissement, permet d’éviter l’admission aux soins intensifs et réduit la mortalité des patients hospitalisés (Elgazzar et al., 2020; Hashim et al., 2020; Khan, M.S.I. et al., 2020; Niaee et al., 2020; Patel et al., 2020; Spoorthi and Sasank, 2020; Rajter et al., 2021).
- L’ivermectine réduit la mortalité chez les patients atteints d’une forme grave de Covid19 (Elgazzar et al., 2020; Hashim et al., 2020; Rajter et al., 2021).
- L’ivermectine entraîne des réductions frappantes des taux de létalité dans les régions où son utilisation est répandue (Chamie, 2020).
BILAN DES ETUDES SCIENTIFIQUES
Au 11 mars 2021, il existe 68 études scientifiques évaluant l’effet de l’ivermectine sur le SARS-CoV-2, dont 33 ont été revues par des pairs.
Parmi ces 68 études scientifiques, il existe 50 essais cliniques avec des résultats comparant des groupes traités et contrôle. Dans ces 50 essais cliniques (dont 24 randomisés), l’ivermectine a été utilisée dans :
11 essais à titre prophylactique
39 essais dans le traitement de la COVID-19 (19 précocement dès les premiers symptômes et 20 à des stades tardifs et souvent graves de la Covid19.)
De plus, il existe 17 essais cliniques en cours dont les résultats sont attendus pour 2021 (www.clinicaltrials.gov).
Voici un résumé des résultats statistiquement significatifs des essais contrôlés, pouvant servir de base de preuves cliniques pour l’utilisation potentielle de l’ivermectine dans la Covid19 (voir tableaux récapitulatifs Annexe) :
Essais contrôlés dans la prophylaxie de la Covid19 (11 études) (Tableau Annexe 1)
Les 11 essais contrôlés disponibles montrent tous des réductions statistiquement significatives de la transmission :
- 4 essais contrôlés randomisés (RCT) avec des réductions statistiquement significatives des taux de transmission, N=1238 patients (Elgazzar et al., 2020; Vallejos et al., 2020; Chahla, 2021; Shouman et al., 2021),
- 7 essais contrôlés observationnels (OCT) avec des réductions statistiquement significatives des taux de transmission, N=5329 patients (Alam, Murshed, Gomes, et al., 2020; Carvallo, 2020; Carvallo, Hirsch, Psaltis, et al., 2020; Bernigaud et al., 2021; Hellwig and Maia, 2021; P Behera et al., 2021; Priyamadhaba Behera et al., 2021).
Essais contrôlés dans le traitement de la Covid19 (39 études) (Tableaux annexe 2 et 3)
Actuellement, 19 essais comprenant au total plus de 3 000 patients atteints de formes légères de la maladie en consultation externe ont été réalisés. Ces essais comprennent 13 RCT (Afsar et al., 2020; Asghar, 2020; Podder et al., 2020; Raad, 2020; Chowdhury et al., 2020; Hashim et al., 2020; Mahmud, 2020; Mohan et al., 2021; Babalola et al., 2021; Chaccour et al., 2021; Kirti et al., 2021; Lima-Morales et al., 2021; López-Medina et al., 2021), 2 essais observationnels (Cadegiani et al., 2020; Elalfy et al., 2021) et de quatre séries de cas (Alam, Murshed, Bhiuyan, et al., 2020; Carvallo, Hirsch, and Farinella, 2020; Espitia-Hernandez et al., 2020; Morgenstern et al., 2020).
Sur ces 19 essais utilisant l’ivermectine en traitement précoce en ambulatoire, 15 essais montrent des effets bénéfiques de la molécule, 3 essais sont sans différence significative, malgré une tendance positive, et un seul essai ne montre pas d’amélioration (Tableau annexe 2).
Les effets bénéfiques de l’ivermectine en traitement précoce de la Covid19 qui sont décrits dans ces essais sont :
- Amélioration de la symptomatologie clinique
- Réduction du temps de récupération
- Réduction du portage viral, réduction du temps de négativation du test PCR
- Réduction du risque d’hospitalisation
- Réduction de la mortalité globale
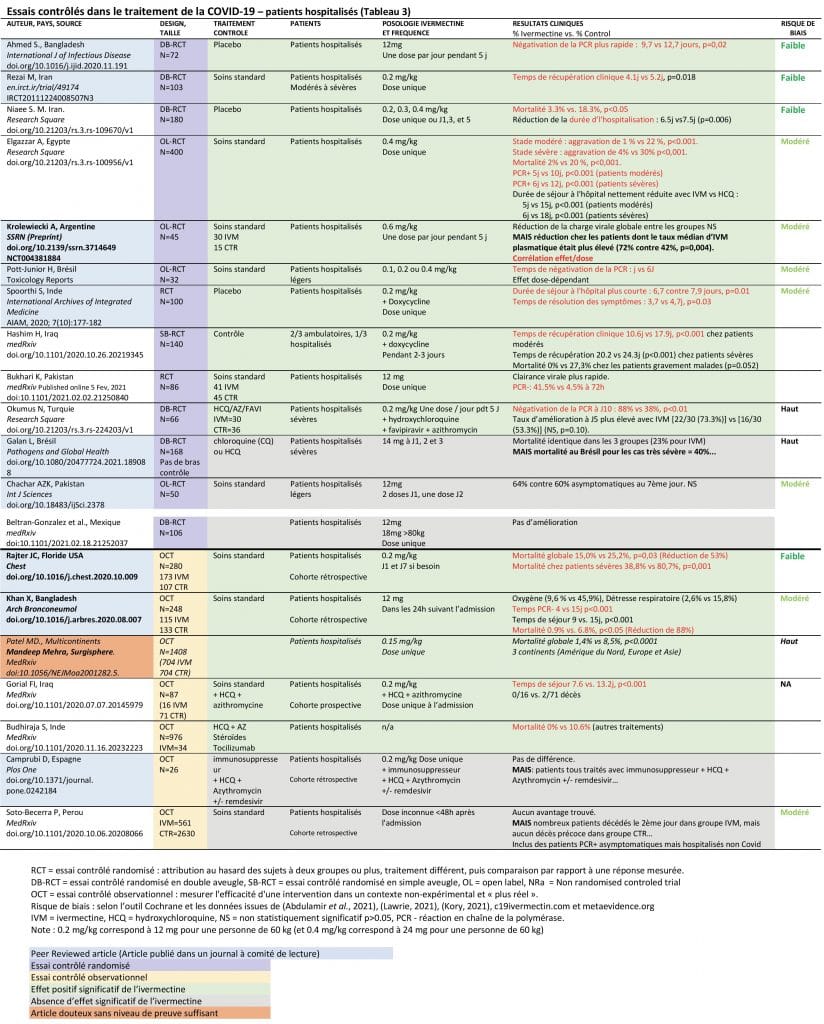
Il existe 20 essais utilisant l’ivermectine en traitement à des stades avancés de la maladie sur des patients hospitalisés. Ces essais comprennent 13 RCT (Rezai, 2020; Spoorthi and Sasank, 2020; Chachar et al., 2020; Elgazzar et al., 2020; Hashim et al., 2020; Krolewiecki et al., 2020; Niaee et al., 2020; Okumus et al., 2020; Ahmed et al., 2021; Beltran-Gonzalez et al., 2021; Pott-Junior et al., 2021; Bukhari et al., 2021; Galan et al., 2021), 6 OCT (Budhiraja et al., 2020; Camprubí et al., 2020; Gorial et al., 2020; Khan, M.S.I. et al., 2020; Patel et al., 2020; Rajter et al., 2021) et une étude rétrospective d’analyse de base de données (Soto-Becerra et al., 2020).
Sur ces 20 essais utilisant l’ivermectine sur des stades sévères de la maladie, 15 essais montrent un effet bénéfique de la molécule et 5 études sont sans différence significative (Tableau annexe 3).
Les effets bénéfiques de l’ivermectine en traitement tardif de la Covid19 chez les patients hospitalisés qui sont décrits dans ces essais sont :
- Réduction du temps de récupération clinique
- Réduction du temps de négativation du test PCR
- Réduction de la durée d’hospitalisation
- Réduction des admissions en réanimation
- Réduction de la mortalité globale
CONCLUSION
L’ensemble des études existantes montre une amélioration de la survie, un rétablissement clinique plus rapide et des signes d’effet dose-dépendant de la clairance virale pour les patients traités par ivermectine plutôt que par contrôle. Même si des essais cliniques supplémentaires, de meilleure qualité et à plus grande échelle, ne pourraient être que bénéfiques, il est intéressant de noter que les avantages apparents de l’ivermectine contre la Covid-19 semblent pouvoir s’appliquer à tous les stades de la maladie, de la prophylaxie au traitement des patients gravement malades.
Trois méta-analyses sur ce sujet ont été réalisées (Abdulamir et al., 2021; Kory, 2021; Lawrie, 2021). Les résultats de ces trois méta-analyses sont tous concordants sur l’efficacité de l’ivermectine dans la Covid19, avec une baisse de la mortalité entre 65% à 90%, et une baisse du risque d’infection en prophylaxie de plus de 80% ainsi qu’à une diminution significative de la durée d’hospitalisation et du délai de guérison grâce au traitement par l’ivermectine de patients atteints d’une COVID-19.
Une recommandation temporaire d’utilisation (RTU) pour l’ivermectine comme traitement pour la Covid-19 a été déposée auprès de l’Agence nationale de la sûreté du médicament (ANSM) le 25 janvier 2021. L’ANSM s’est engagée à donner une réponse dans les meilleurs délais.
Rappelons que la situation d’urgence sanitaire a permis en quelques semaines d’autoriser le Remdesivir et le bamlanivimab (à base d’anticorps monoclonaux) pour certains patients Covid-19 grâce à une ATU (Autorisation Temporaire d’Utilisation). Il est à noter qu’une ATU est plus difficile à obtenir qu’une RTU, la RTU concernant des médicaments aux effets connus, ayant déjà une AMM, alors que l’ATU concerne des médicaments sans AMM.
Enfin, le Dr Satoshi Omura, le découvreur de l’ivermectine en personne, a déclaré le 11 Mars 2021 qu’une approbation spéciale devrait être donnée (ici)
ANNEXES
Tableau 1 : Essais contrôlés dans la prophylaxie de la Covid-19
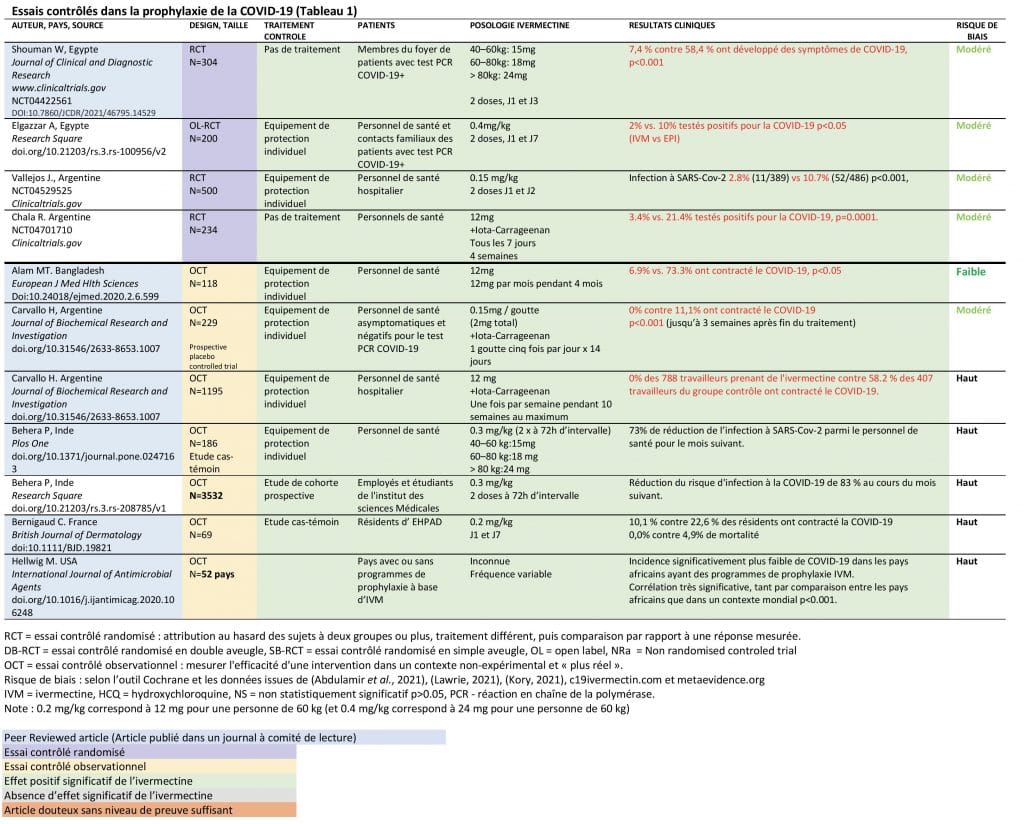
Tableau 2 : Essais contrôlés dans le traitement de la Covid-19 – patients ambulatoires
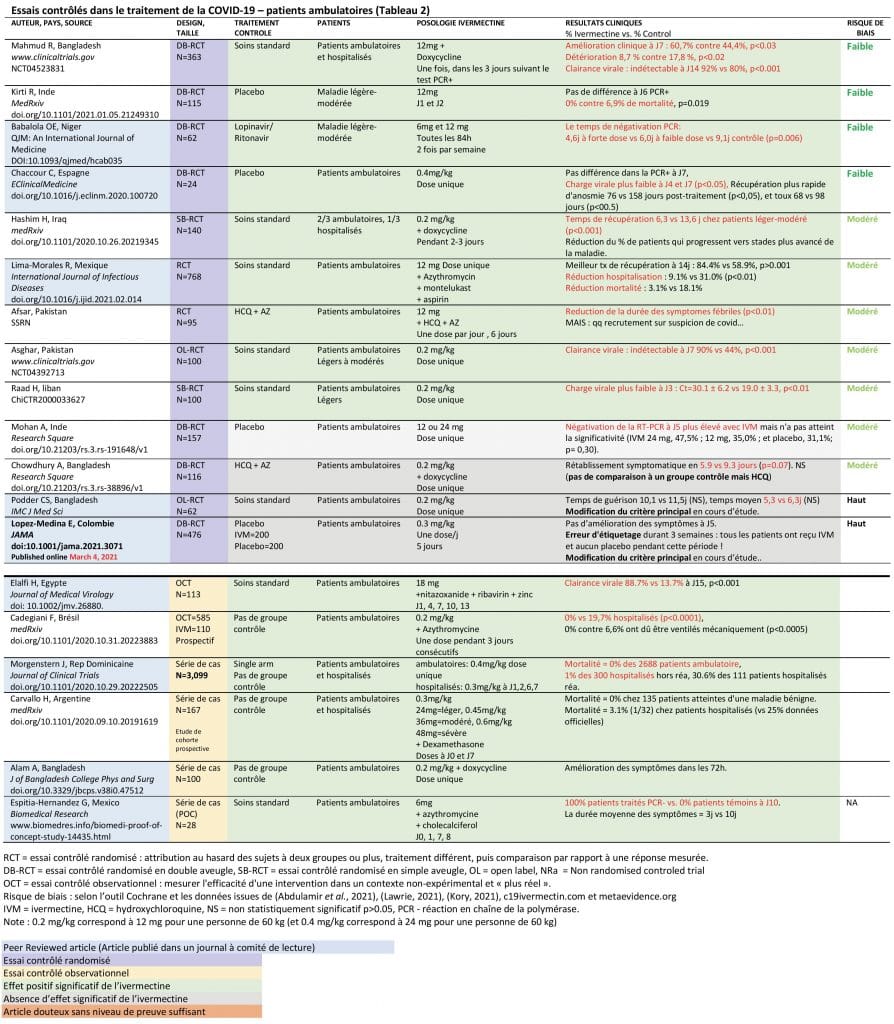
Tableau 3 : Essais contrôlés dans le traitement de la Covid-19 – patients hospitalisés
A Retenir
- 68 études scientifiques évaluant l’effet de l’ivermectine sur le SARS-CoV-2 (dont 33 ont été revues par des pairs).
- 50 essais cliniques (dont 24 randomisés).
- L’ivermectine réduit la transmission et le développement de la Covid-19 chez les personnes exposées à des patients infectés,
- L’ivermectine accélère la guérison et prévient la détérioration des patients présentant une forme légère à modérée de la maladie,
- L’ivermectine évite l’admission aux soins intensifs des patients hospitalisés,
- L’ivermectine réduit la mortalité chez les patients atteints de Covid-19.
Références
https://www.covid19treatmentguidelines.nih.gov/antiviral-therapy/ivermectin/
https://clinicaltrials.gov/ct2/home
Abdulamir AS, Ahmed S, Asghar A, Babalola OE, Basri R, Chachar AZK, Chowdhury ATMM, Elgazzar A, Ellis L, Falconer J, Garratt A, Hany BM, Hashim HA, Haque WMMU, Hayat A, He S, Jamshidian R, Khan WA, Kirti R, Krolewiecki A, Lanusse C, Levi J, Mahmud R, Mangat SA, McCann K, Mohan A, Niaee MS, Okumuş N, Pilkington V, Podder CS, Qavi A, Raad H, Samaha A, Mouawia H, Rezai MS, Sasank S, Spoorthi V, Suri T, Wang J, Wentzel H, and Hill A (2021) Preliminary meta-analysis of randomized trials of ivermectin to treat SARS-CoV-2 infection. Res Sq.
Afsar NA, Ghauri MI, Abbas M, Mukarram MS, Peracha MY, and Ishaq K (2020) Ivermectin use associated with reduced duration of COVID-19 febrile illness in a community setting. SSRN Electron J.
Ahmed S, Karim MM, Ross AG, Hossain MS, Clemens JD, Sumiya MK, Phru CS, Rahman M, Zaman K, Somani J, Yasmin R, Hasnat MA, Kabir A, Aziz AB, and Khan WA (2021) A five-day course of ivermectin for the treatment of COVID-19 may reduce the duration of illness. Int J Infect Dis 103:214–216.
Alam MT, Murshed R, Bhiuyan E, Saber S, Alam RF, and Robin RC (2020) A Case Series of 100 COVID-19 Positive Patients Treated with Combination of Ivermectin and Doxycycline. J Bangladesh Coll Physicians Surg 38:10–15.
Alam MT, Murshed R, Gomes PF, Masud ZM, Saber S, Chaklader MA, Khanam F, Hossain M, Momen ABIM, Yasmin N, Alam RF, Sultana A, and Robin RC (2020) Ivermectin as Pre-exposure Prophylaxis for COVID-19 among Healthcare Providers in a Selected Tertiary Hospital in Dhaka – An Observational Study. Eur J Med Heal Sci 2:1–5.
Arévalo A, Pagotto R, Pórfido J, Daghero H, Segovia M, Yamasaki K, Varela B, Hill M, Verdes J, Vega MD, Bollati-Fogolín M, and Crispo M (2020) Ivermectin reduces coronavirus infection in vivo: a mouse experimental model. bioRxiv.
Asghar A (2020) Efficacy of Ivermectin in COVID-19. Clin Trials.gov NCT0439271.
Babalola O, Bode C, Ajayi A, Alakaloko F, Akase I, Otrofanowei E, Salu O, Adeyemo W, Ademuyiwa A, and Omilabu S (2021) Ivermectin shows clinical benefits in mild to moderate COVID19: A randomised controlled double-blind, dose-response study in Lagos. QJM An Int J Med, doi: https://doi.org/10.1093/qjmed/hcab035.
Behera P, Patro B, Padhy B, Mohapatra P, Bal S, Chandanshive P, Mohanty R, Ravikumar S, Singh A, Singh S, Pentapati S, Nair J, and Batmanabane G (2021) Prophylactic role of ivermectin in SARS-CoV-2 infection among healthcare workers. Res Sq 1–15.
Behera Priyamadhaba, Patro BK, Singh AK, Chandanshive PD, Ravi Kumar SR, Pradhan SK, Pentapati SSK, Batmanabane G, Padhy BM, Bal S, Singh SR, and Mohanty RR (2021) Role of ivermectin in the prevention of COVID-19 infection among healthcare workers in India: A matched case-control study. PLoS One 1–12.
Beltran-Gonzalez JL, González Gámez M, Mendoza Encis EA, Maldonado RJE, Palacios DH, Campos SD, Robles IO, Guzmán MJM, Díaz ALG, Gutiérrez Peña CM, Medina LM, Monroy Colin VA, and Arreola Guerra JM (2021) Efficacy and safety of Ivermectin and Hydroxychloroquine in patients with severe COVID-19. A randomized controlled trial. medRxiv, doi: doi.org/10.1101/2021.02.18.21252037;
Bernigaud C, Guillemot D, Ahmed‐Belkacem A, Grimaldi‐Bensouda L, Lespine A, Berry F, Softic L, Chenost C, Do‐Pham G, Giraudeau B, Fourati S, and Chosidow O (2021) Oral ivermectin for a scabies outbreak in a long‐term–care facility: Potential value in preventing COVID‐19 and associated mortality? Br J Dermatol 0–2.
Budhiraja S, Soni A, Jha V, Indrayan A, Dewan A, Singh O, Singh YP, Chugh I, Arora V, Pande R, Ansari A, and Jha S (2020) Clinical Profile of First 1000 COVID-19 Cases Admitted at Tertiary Care Hospitals and the Correlates of their Mortality: An Indian Experience. medRxiv, doi: doi.org/10.1101/2020.11.16.20232223.
Bukhari K, Asghar A, Perveen N, Hayat A, Mangat S, Butt K, Abdullah M, Fatima T, Mustafa A, and Iqbal T (2021) Efficacy of Ivermectin in COVID-19 Patients with Mild to Moderate Disease. medRxiv, doi: doi.org/10.1101/2021.02.02.21250840.
Cadegiani F, Goren A, McCoy J, and Wambier C (2020) Hydroxychloroquine, nitazoxanide and ivermectin have similar effects in early COVID-19: a head-to-head comparison of the Pre-AndroCoV Trial. Res Sq, doi: doi.org/10.21203/rs.3.rs-98106/v1.
Caly L, Druce JD, Catton MG, Jans DA, and Wagstaff KM (2020) The FDA-approved drug ivermectin inhibits the replication of SARS-CoV-2 in vitro. Antiviral Res 178:104787, Elsevier B.V.
Camprubí D, Almuedo-Riera A, Martí-Soler HI, Soriano A, Hurtado JC, Subirà C, Grau-Pujol B, Krolewiecki A, and Muñoz J (2020) Lack of efficacy of standard doses of ivermectin in severe COVID-19 patients. PLoS One 15:1–6.
Carvallo HE (2020) Usefulness of Topic Ivermectin and Carrageenan to Prevent Contagion of Covid 19 (IVERCAR). Clin Trials.gov NCT0442585.
Carvallo HE, Hirsch RR, and Farinella ME (2020) Safety and efficacy of the combined use of ivermectin, dexamethasone, enoxaparin and aspirin against COVID-19. medRxiv, doi: 10.1101/2020.09.10.20191619.
Carvallo HE, Hirsch RR, Psaltis A, and Contrera V (2020) Study of the Efficacy and Safety of Topical Ivermectin + Iota- Carrageenan in the Prophylaxis against COVID-19 in Health Personnel. J Biomed Res Clin Investig 2:1–6.
Chaccour C, Casellas A, Blanco-Di Matteo A, Pineda I, Fernandez-Montero A, Ruiz-Castillo P, Richardson M-A, Rodríguez-Mateos M, Jordán-Iborra C, Brew J, Carmona-Torre F, Giráldez M, Laso E, Gabaldón-Figueira JC, Dobaño C, Moncunill G, Yuste JR, Del Pozo JL, Rabinovich NR, Schöning V, Hammann F, Reina G, Sadaba B, and Fernández-Alonso M (2021) The effect of early treatment with ivermectin on viral load, symptoms and humoral response in patients with non-severe COVID-19: A pilot, double-blind, placebo-controlled, randomized clinical trial. EClinicalMedicine 100720.
Chachar AZK, Khan KA, Asif M, Tanveer K, Khaqan A, and Basri R (2020) Effectiveness of Ivermectin in SARS-CoV-2/COVID-19 Patients. Int J Sci 9:31–35.
Chahla RE (2021) Prophylaxis Covid-19 in Healthcare Agents by Intensive Treatment With Ivermectin and Iota-carrageenan (Ivercar-Tuc). Clin Trials.gov NCT0470171.
Chamie J (2020) Real-World Evidence : The Case of Peru Causality between Ivermectin and COVID-19 Infection Fatality Rate.
Chowdhury ATMM, Shahbaz M, Karim MR, Islam J, Guo D, and He S (2020) A Randomized Trial of Ivermectin-Doxycycline and Hydroxychloroquine-Azithromycin therapy on COVID19 patients. Res Sq 1–19.
Ci X, Li H, Yu Q, Zhang X, Yu L, Chen N, Song Y, and Deng X (2009) Avermectin exerts anti-inflammatory effect by downregulating the nuclear transcription factor kappa-B and mitogen-activated protein kinase activation pathway. Fundam Clin Pharmacol 23:449–455.
Crump A, and Omura S (2011) Ivermectin, “Wonder drug” from Japan: The human use perspective. Proc Japan Acad Ser B Phys Biol Sci 87:13–28.
De Melo, G.D., Lazarini F, Larrous F, Feige L, Kergoat L, Marchio A, Pineau P, Lecuit M, Lledo P-M, Changeux J-P, and Bourhy H (2020) Anti-COVID-19 efficacy of ivermectin in the golden. bioRxiv.
Elalfy H, Besheer T, El-Mesery A, El-Gilany A-H, Abd Elazez MS, Alhawarey A, Alegezy M, Elhadidy T, Hewidy AA, Zaghloul H, Neamatallah MAM, Raafat D, El-Emshaty WM, Abo El Kheir NY, and El-Bendary M (2021) Effect of a combination of Nitazoxanide, Ribavirin and Ivermectin plus zinc supplement (MANS.NRIZ study) on the clearance of mild COVID-19. J Med Virol 0–2.
Elgazzar A, Hany B, and Youssef SA (2020) Efficacy and Safety of Ivermectin for Treatment and prophylaxis of COVID-19 Pandemic. Res Sq 1–9.
Espitia-Hernandez G, Munguia L, Diaz-Chiguer D, Lopez-Elizalde R, and Jimenez-Ponce F (2020) Effects of Ivermectin-azithromycin-cholecalciferol combined therapy on COVID-19 infected patients: A proof of concept study. Biomed Res 31.
Galan BEL, Melo N, Asato MS, Araújo JV, Moreira ADL, Marques AM, Diogenes A, Paiva P, Guilherme D, Portella S, Silas F, Marques S, Melo G, Silva A, Sousa J De, Tizolim MR, Santos PL, Buttenbender F, Andrade SB De, Cruz RC, Gomes J, Rocha D, Guilherme R, Souza S De, Araújo JV, Moreira ADL, Mahara A, Araújo M, Paiva DP, Guilherme D, Portella S, Silas F, Marques S, Melo G, Silva A, Resende JDS, Tizolim MR, Santos L, Buttenbender SF, Andrade SB De, and Carlos R (2021) Phase 2 randomized study on chloroquine , hydroxychloroquine or ivermectin in hospitalized patients with severe manifestations of SARS-CoV-2 infection. Pathog Glob Health 00:1–8, Taylor & Francis.
Gorial FI, Mashhadani S, Sayaly HM, Dakhil BD, AlMashhadani MM, Aljabory AM, Abbas HM, Ghanim M, and Rasheed JI (2020) Effectiveness of ivermectin as add-on therapy in COVID-19 management (pilot trial). medRxiv 2:2–13.
Gupta D, Sahoo AK, and Singh A (2020) Ivermectin: potential candidate for the treatment of Covid 19. Brazilian J Infect Dis 24:369–371.
Hashim HA, Maulood MF, Rasheed AM, Fatak DF, Kabah KK, and Abdulamir AS (2020) Controlled randomized clinical trial on using Ivermectin with Doxycycline for treating COVID-19 patients in Baghdad, Iraq. medRxiv 48.
Heidary F, and Gharebaghi R (2020) Ivermectin: a systematic review from antiviral effects to COVID-19 complementary regimen. J Antibiot (Tokyo) 73:593–602, Springer US.
Hellwig MD, and Maia A (2021) A COVID-19 prophylaxis? Lower incidence associated with prophylactic administration of ivermectin. Int J Antimicrob Agents 57, Elsevier Ltd.
Khan, M.S.I., Khan MSI, Debnath CR, Nath PN, Mahtab MA, Nabeka H, Matsuda S, and Akbar SMF (2020) Ivermectin Treatment May Improve the Prognosis of Patients With COVID-19. Arch Bronconeumol 56:816–830.
Kircik LH, Del Rosso JQ, Layton AM, and Schauber J (2016) Over 25 years of clinical experience with ivermectin: An overview of safety for an increasing number of indications.
Kirti R, Roy R, Chandrima P, Rishav R, Neeraj A, Bijit B, Pramod KM, Deependra KR, Shyama, Anjani K, and Asim S (2021) Ivermectin as a potential treatment for mild to moderate COVID-19 – A double blind randomized placebo-controlled trial. medRxiv.
Kory P (2021) Review of the Emerging Evidence Supporting the Use of Ivermectin in the Prophylaxis and Treatment of COVID-19. Front Line COVID-19 Crit Care Alliance 1–21.
Krolewiecki A, Lifschitz A, Moragas M, Travacio M, Valentini R, Alonso DF, Solari R, Tinelli MA, Cimino RO, Álvarez L, Fleitas PE, Ceballos L, Golemba MD, Fernández F, Fernández de Oliveira D, Astudillo G, Baeck I, Farina J, Guthmann MD, Cardama GA, Mangano A, Spitzer E, Gold S, and Lanusse C (2020) Antiviral Effect of High-Dose Ivermectin in Adults with COVID-19: A Pilot Randomised, Controlled, Open Label, Multicentre Trial. SSRN Electron J, doi: 10.2139/ssrn.3714649.
Lawrie T (2021) Ivermectin reduces the risk of death from COVID-19 – a rapid review and meta-analysis in support of the recommendation of the Front Line COVID-19 Critical Care Alliance. Res gate.
Lehrer S, and Rheinstein PH (2020) Ivermectin docks to the SARS-CoV-2 spike receptor-binding domain attached to ACE2. In Vivo (Brooklyn) 34:3023–3026.
Lima-Morales R, Mendez-Hernandez P, Flores YN, Osorno-Romero P, Cuecuecha-Rugerio E, Nava-Zamora A, Hernandez-Galdamez DR, Romo-Duenas DK, and Salmeron J (2021) Effectiveness of a multidrug therapy consisting of ivermectin, azithromycin, montelukast and acetylsalicylic acid to prevent hospitalization and death among ambulatory COVID-19 cases in Tlaxcala, Mexico. Int J Infect Dis, doi: https://doi.org/10.1016/j.ijid.2021.02.014.
López-Medina E, López P, Hurtado IC, Dávalos DM, Ramirez O, Martínez E, Díazgranados JA, Oñate JM, Chavarriaga H, Herrera S, Parra B, Libreros G, Jaramillo R, Avendaño AC, Toro DF, Torres M, Lesmes MC, Rios CA, and Caicedo I (2021) Effect of Ivermectin on Time to Resolution of Symptoms Among Adults With Mild COVID-19: A Randomized Clinical Trial. Jama 1–10.
Mahmud R (2020) Clinical Trial of Ivermectin Plus Doxycycline for the Treatment of Confirmed Covid-19 Infection. Clin Trials.gov NCT0452383.
Mohan A, Tiwari P, Suri T, Patel A, Jain A, Kumar Das U, Bopanna TK, Shelke S, Rajan Singh A, Bhatnagar S, Masih Mahajan Imaging Shelly Mahajan Mahajan Imaging Tanima Dwivedi S, Sahoo B, Bhopale S, Vig S, Gupta R, Madan K, Hadda V, Gupta N, Garg R, Prakash Meena V, and Guleria R (2021) Ivermectin in mild and moderate COVID-19 (RIVET-COV): a randomized, placebo-controlled trial. 19.
Morgenstern J, Redondo JN, de León A, Canela JM, Torres N, Tavares J, Minaya M, López Ó, Plácido AM, Castillo A, Cruz RP, Merette Y, Toribio M, Francisco JA, and Roca S (2020) The use of compassionate ivermectin in the management of symptomatic outpatients and hospitalized patients with clinical diagnosis of COVID-19 at the Medical Center Bournigal and the Medical Center Punta Cana, Rescue Group, Dominican Republic, from may 1. J Clin Trials 11:9–12.
Niaee MS, Gheibi N, Namdar P, Allami A, Zolghadr L, Javadi A, Karampour A, Varnaseri M, Bizhani B, Cheraghi F, Naderi Y, Amini F, Karamyan M, Yadyad MJ, and Jamshidian R (2020) Ivermectin as an adjunct treatment for hospitalized adult COVID-19 patients: A randomized multi-center clinical trial (preprint). Res Sq 1–18.
Okumus N, Demirtürk N, ÇETİNKAYA R, GÜNER R, ESER F, and TAŞKIN G (2020) Evaluation of the Effectiveness and Safety of Adding Ivermectin to Treatment in Severe COVID-19 Patients. Res Sq, doi: doi.org/10.21203/rs.3.rs-224203/v1.
Õmura S (2008) Ivermectin: 25 years and still going strong. Int J Antimicrob Agents 31:91–98.
Patel AN, Mba SSD, and Grainger DW (2020) Usefulness of Ivermectin in COVID-19 Illness. https://kitasato-infection-control.info/swfu/d/COVID-19_Illness.pdf 1–13.
Podder C, Chowdhury N, Sina M, and Haque W (2020) Outcome of ivermectin treated mild to moderate COVID-19 cases: a single-centre, open-label, randomised controlled study. IMC J Med Sci 14:2.
Pott-Junior H, Bastos M, Queiroz A De, Miguel C, Ferreira A, Goi M, Sousa S De, and Gama S (2021) Use of ivermectin in the treatment of Covid-19 : A pilot trial. Toxicol Reports 8:505–510.
Raad H (2020) In vivo use of ivermectin (IVR) for treatment for corona virus infected patients (COVID-19): a randomized controlled trial. Unpublished.
Rajter JC, Sherman MS, Fatteh N, Vogel F, Sacks J, and Rajter JJ (2021) Use of Ivermectin Is Associated With Lower Mortality in Hospitalized Patients With Coronavirus Disease 2019: The Ivermectin in COVID Nineteen Study. Chest 159:85–92, Elsevier Inc.
Rezai MS (2020) Effectiveness of Ivermectin in the Treatment of Coronavirus Infection in Patients admitted to Educational Hospitals of Mazandaran in 2020. en.irct.ir/trial.
Sen Gupta PS, Biswal S, Panda SK, Ray AK, and Rana MK (2020) Binding mechanism and structural insights into the identified protein target of COVID-19 and importin-α with in-vitro effective drug ivermectin. J Biomol Struct Dyn 0:1–10, Taylor & Francis.
Shouman W, Hegazy A, Nafae R, and Sileem A (2021) Use of Ivermectin as a potential chemoprophylaxis for COVID-19 in Egypt : A Randomised clinical trial. J Clin Diagnostic Res 27–32.
Soto-Becerra P, Culquichicón C, Hurtado-Roca Y, and Araujo-Castillo R V. (2020) Real-World Effectiveness of hydroxychloroquine, azithromycin, and ivermectin among hospitalized COVID-19 patients: Results of a target trial emulation using observational data from a nationwide Healthcare System in Peru. medRxiv, doi: doi.org/10.1101/2020.10.06.20208066;
Spoorthi V, and Sasank S (2020) Utility of Ivermectin and Doxycycline combination for the treatment of SARS-CoV-2. Int Arch Integr Med 7:177–182.
Swargiary A (2020) Ivermectin as a promising RNA-dependent RNA polymerase inhibitor and a therapeutic drug against SARS-CoV2: Evidence from in silico studies. Res Sq.
Vallejos J, Zoni R, Bangher M, Villamandos S, Bobadilla A, Plano F, Campias C, Chaparro Campias E, Achinelli F, Guglielmone HA, Ojeda J, Medina F, Farizano Salazar D, Andino G, Ruiz Diaz NE, Kawerin P, Meza E, Dellamea S, Aquino A, Flores V, Martemucci CN, Vernengo MM, Martinez SM, Segovia JE, and Aguirre MG (2020) Ivermectin to prevent hospitalizations in patients with COVID-19 (IVERCOR-COVID19): a structured summary of a study protocol for a randomized controlled trial. Trials 21:10–13, Trials.
Yang SNY, Atkinson SC, Wang C, Lee A, Bogoyevitch MA, Borg NA, and Jans DA (2020) The broad spectrum antiviral ivermectin targets the host nuclear transport importin α/β1 heterodimer. Antiviral Res 177, Elsevier.
Zhang X, Song Y, Ci X, An N, Ju Y, Li H, Wang X, Han C, Cui J, and Deng X (2008) Ivermectin inhibits LPS-induced production of inflammatory cytokines and improves LPS-induced survival in mice. Inflamm Res 57:524–529.
Zhang X, Song Y, Xiong H, Ci X, Li H, Yu L, Zhang L, and Deng X (2009) Inhibitory effects of ivermectin on nitric oxide and prostaglandin E2 production in LPS-stimulated RAW 264.7 macrophages. Int Immunopharmacol 9:354–359.

Bonjour, je suis les travaux du FLCCC aux États-Unis et du groupe Bird en Angleterre depuis novembre 2020. J’ai aussi écouté plusieurs présentations du dr Paul Marik expliquant le fonctionnement du sars cov2. Ma question: est-ce éthique, au Québec, d’avoir ignoré toutes ces données sur l’efficacité de l’ivermectine? Sachant que le traitement précoce de la maladie est préférable combien de vies auraient pu être sauvé et combien de long covid aurait pu être évité depuis novembre 2020?
J’ajouterais, y a t-il eu négligence criminelle de la part de nos élus ? Sont-ils imputables de leur manque de vision ?
Il faut mettre quelques informations à jour. La réponse de l’ANSM est défavorable. Les échantillons des études sur l’ivermectine sont trop petits pour accéder à l’utilisation d’urgence. Les études ne sont toutefois pas sans intérêt, c’est juste que l’ANSM requiert des essais cliniques plus solides avec des échantillons plus grand.
https://www.pharmacovigilance-champagneardenne.fr/2021/04/02/lansm-publie-sa-decision-sur-la-demande-de-rtu-pour-livermectine-dans-la-prise-en-charge-de-la-maladie-covid-19/
Remède de cheval ?
Le vaccin est plus approprié, de mise …
https://www.lapresse.ca/debats/editoriaux/2021-09-07/ivermectine/se-guerir-des-remedes-de-cheval.php
https://covid19criticalcare.com/ivermectin/
En date de juin 2023, 97 études faites sur l’ivermectine, par 1056 scientifiques, avec 135 766 patients dans 27 pays. Sans compter que les vaccins, en bout de ligne, n’ont pas tenus leurs promesses.
L’article de la presse n’est pas très fouillé! Par exemple, fin août, un des médecins japonais les plus respectés du pays, le Docteur Haruo Ozaki, a déclaré publiquement qu’il fallait avoir recours à l’ivermectine dans la lutte au coronavirus.
Le Japon, l’Allemagne et près d’une vingtaine de pays ont adoptés l’ivermectine comme première ligne de défense. Silence des médias, le journalisme est mort.